读特客户端·深圳新闻网2021年9月10日讯(记者 李旖露)9月10日,记者从深圳微芯生物科技股份有限公司(以下简称“微芯生物”)获悉,近日,公司收到美国食品药品监督管理局(FDA)签发的孤儿药资格认定。产品名称为西奥罗尼,适应症为治疗小细胞肺癌。
西奥罗尼是微芯生物自主设计和研发的具有全球专利保护的新化学结构体,属于多靶点多通路选择性激酶抑制剂。“孤儿药”是用于治疗发病率极低、但严重威胁患者生命健康的罕见病药品。为鼓励罕见病药品的研发,FDA会授予可安全有效地治疗、诊断和预防罕见病的药品“孤儿药”认定资格。获得该资格的制药企业将获得监管费用减免、临床税收减免、市场独占权等药品开发激励。
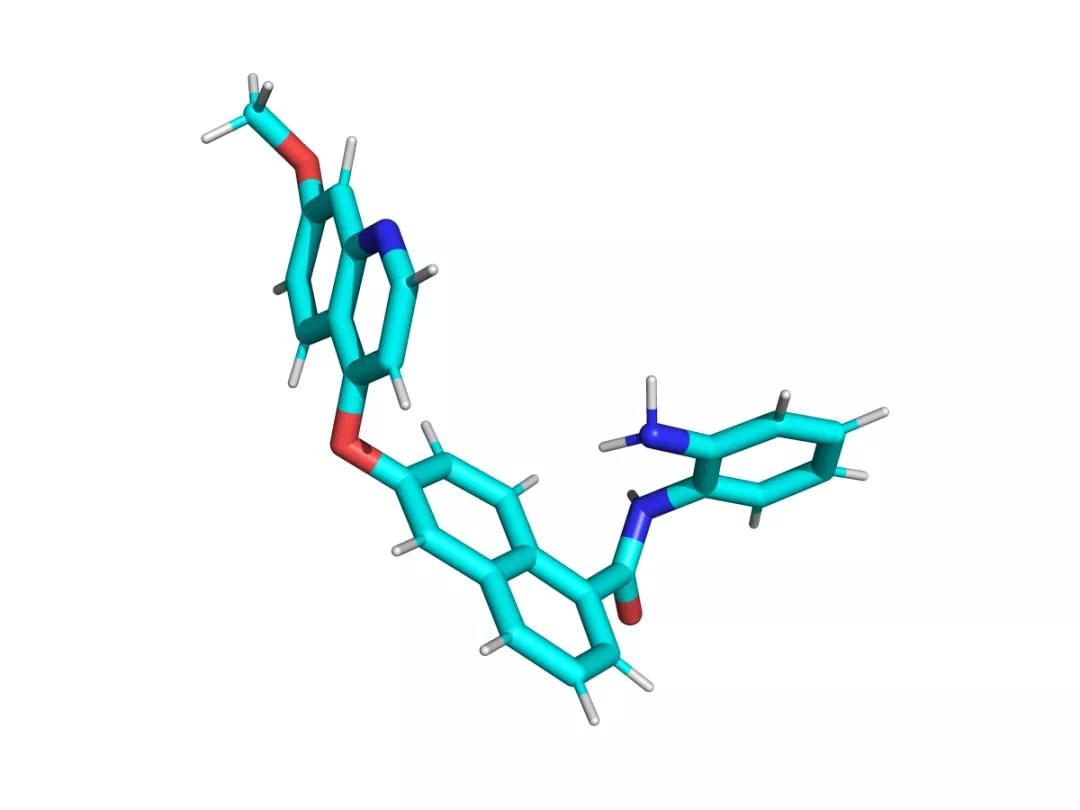
(西奥罗尼分子式)
小细胞肺癌(SCLC)约占肺癌总数的15%,在中国每年新发病例约11-15万,具有高侵袭性、高复发风险、高倍增速度,早期易发生转移,恶性程度极高。确诊患者30%-40%处于局限期,约60%-70%的患者诊断时即处于广泛期。一线治疗的中位生存期在局限期患者中为15-20个月,在广泛期患者中为8-13个月,而长期生存率在局限期和广泛期患者中仅约有20%和2%。大多数SCLC初治患者对化疗敏感,但很容易产生耐药和复发,往往很难治愈。
西奥罗尼针对Aurora B/VEGFR/PDGFR /c-Kit/CSF1R靶点的高选择性抑制,能同时通过抑制肿瘤血管生成、抑制肿瘤细胞有丝分裂和调节肿瘤微环境三通路,发挥综合抗肿瘤作用,具有相对同类机制药物更优异的动物药效活性和良好的安全性。
据官网介绍,2020年12月,西奥罗尼治疗小细胞肺癌的适应症被国家药品监督管理局药品审评中心(CDE)纳入“突破性治疗品种”。2021年3月,西奥罗尼治疗小细胞肺癌关键性Ⅲ期临床试验申请获中国药品监督管理局批准。2021年4月,西奥罗尼治疗小细胞肺癌的Ib/II期临床试验申请(IND)获美国 FDA批准,这是西奥罗尼在美国递交的首个适应症临床试验申请。此外,西奥罗尼治疗卵巢癌的临床Ⅲ期正在中国开展中,治疗肝癌、三阴性乳腺癌、非霍金淋巴瘤、其他神经内分泌肿瘤正在中国开展临床Ⅱ期试验。
微芯生物董事长兼总经理鲁先平博士表示:“我们不仅致力于攻克广为人知的疾病,也积极关注那些容易被忽视的罕见病和患者群体。感谢美国FDA对于微芯生物和西奥罗尼的认可,这是我们继西达本胺之后,被授予的第二个孤儿药资格,我们将会继续努力,开发更多的原创新药惠及全球患者,为他们带来健康的希望。”
微芯生物是由资深留美归国团队于2001年创立的现代生物医药企业。公司专长于原创新分子实体药物研发,致力于为全球患者提供价格可承受的、临床亟需的、具有革命性疗效的创新机制药物。凭借自主创建的国际先进的“基于化学基因组学的集成式药物发现及早期评价平台”在肿瘤、代谢性疾病、自身免疫性疾病、中枢神经性疾病和抗病毒等五个重大疾病领域已开发出包括西达本胺、西格列他钠、西奥罗尼和CS12192在内的多个原创新药产品线。

